一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请
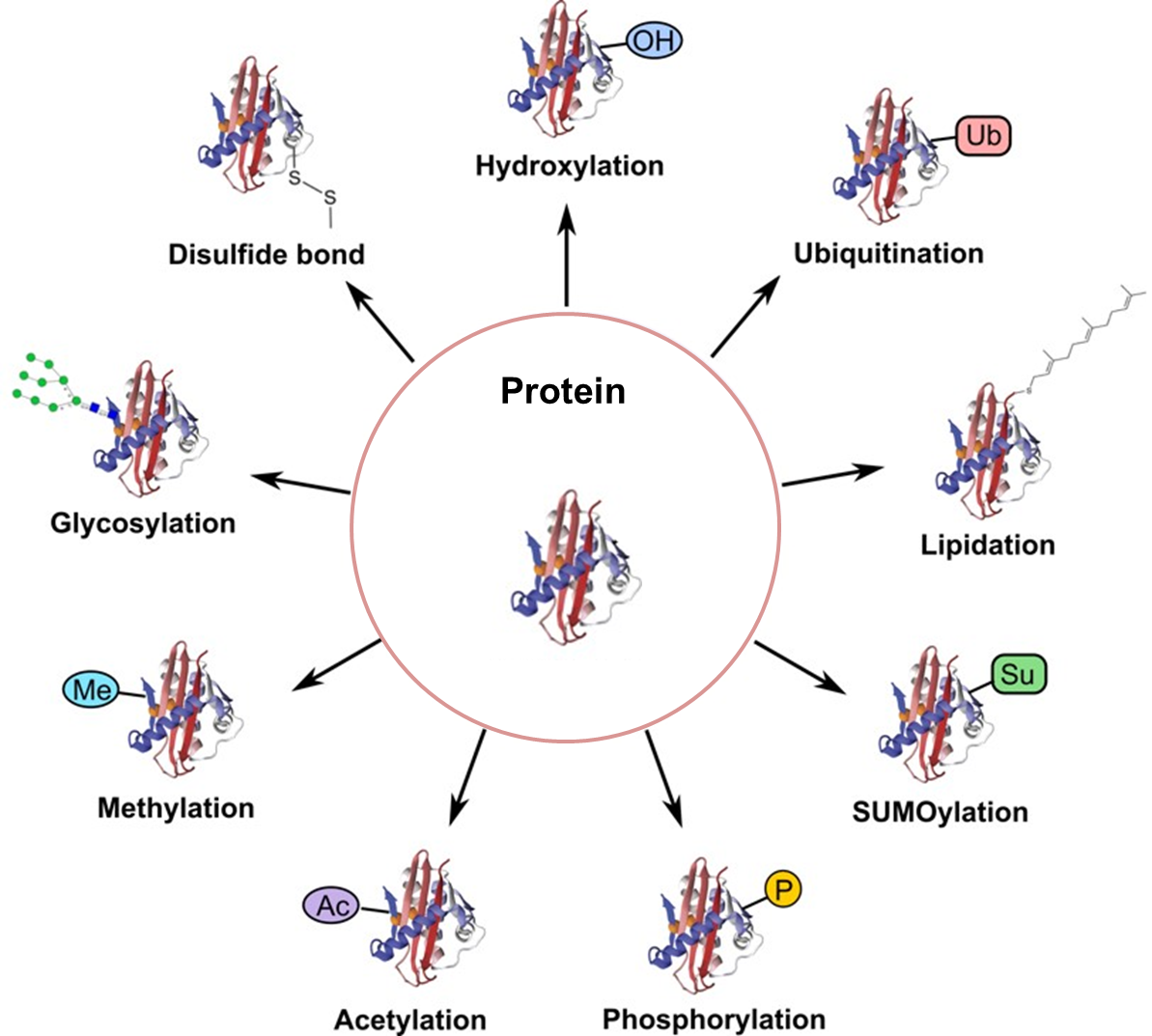
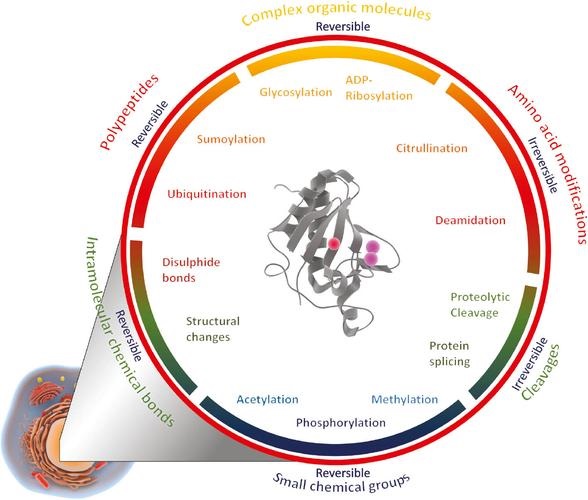
蛋白质翻译后修饰(PTM)通过在一个或多个氨基酸残基上加上修饰基团,可以改变蛋白质的物理、化学性质进而影响蛋白质的空间构象、活性、亚细胞定位、蛋白质折叠以及蛋白质-蛋白质相互作用。PTMs在多种细胞过程,如细胞分裂、蛋白分解、信号传到、调控过程、基因表达调控和蛋白相互作用中起到关键作用。深入研究蛋白质翻译后修饰对揭示生命活动的机理、筛选疾病的临床标志物、鉴定药物靶点等方面都具有重要意义。
部分修饰类型
磷酸化位点定性/定量分析(包括酪氨酸磷酸化分析)、乙酰化定性/定量位点分析、泛素化位点定性/定量分析、糖基化位点定性/定量分析、甲基化位点定性/定量分析、琥珀酰位点定性/定量分析、丙酰位点定性/定量分析化等。
修饰种类(部分) | 应用方向(表型) | 生物学过程 |
磷酸化(S/T) | 所有胁迫(包括生物和非生物胁迫) | 信号转导、细胞周期、生长发育以及癌症机理等 |
磷酸化(Y) | 通常在生长因子、细胞借宿、抗原和应激时发生,是癌症细胞转变过程中的主要信号,目前已知的致癌基因有3/4是酪氨酸激酶基因。 | 细胞通信、生长和增殖、细胞周期调控、癌变的发生和转移、神经传导、血管和胚胎形成、许多先天遗传病和后天疾病的一个关键步骤。 |
泛素化 | 真核生物所有胁迫、癌症以及神经退行性疾病 | 细胞周期、细胞凋亡、转录调控、囊泡运输、DNA修复以及信号转导等 |
乙酰化 | “乙酰化”普遍修饰“代谢酶”,并且可以调节代谢通路及代谢酶的活性。从低等的原核生物到高等的动植物普遍存在。鉴于人体80%疾病与代谢有关,因此在疾病方面普遍存在。>20-30%线粒体蛋白具有营养依赖的乙酰化修饰 | 基因表达调控、细胞凋亡、细胞代谢、蛋白质稳定性、细胞生理状态相关等 |
N糖基化 | N-糖基化的过程在内质网和高尔基中进行、原生动物门中非常少、与疾病相关 | 蛋白质折叠、更新以及免疫应答等 |
棕榈酰化 | 棕榈酰化修饰还参与多种细胞生物学进程,与许多疾病的发生发展密切相关。 | 蛋白质的转运、细胞器定位和功能 |
亚硝基化 | 肺炎、风湿性关节炎、多发性硬化、植物抗病等。 | 动物研究:信号传导、DNA修复、离子通道调节、细胞程序性死亡。 植物研究:过敏细胞死亡、氨基酸转运等。 |
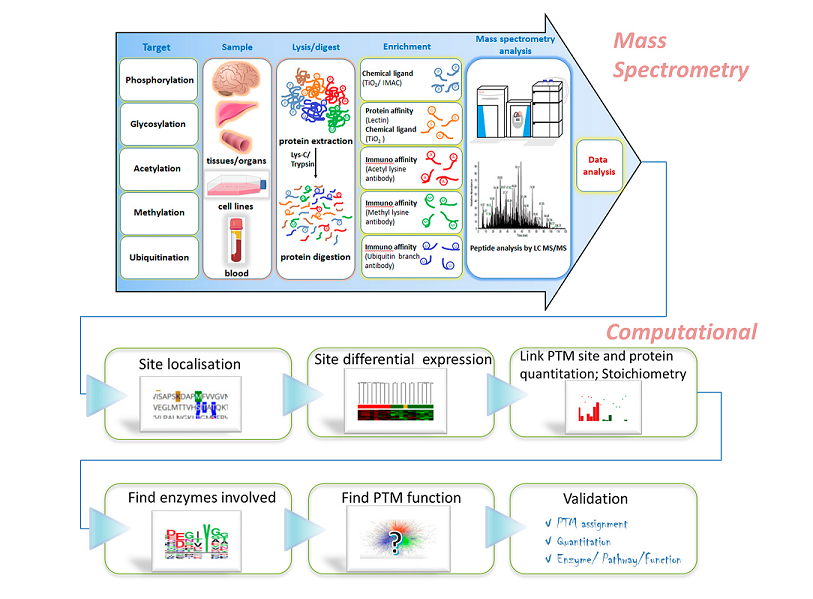
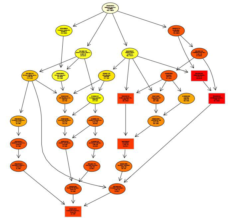
蛋白翻译后修饰(PTM)流程
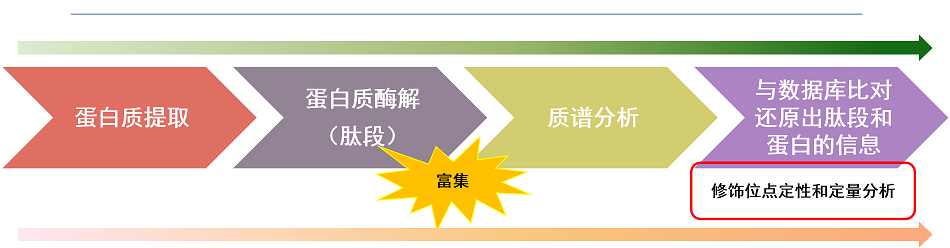
质谱是鉴定PTM的重要方法,其原理是利用蛋白质发生修饰后的质量偏移来实现翻译后修饰位点的鉴定。
由于翻译后修饰的蛋白质在样本中含量低且动态范围广,检测前需要对修饰的蛋白质或肽段进行富集,然后再进行质谱鉴定。
富集方法:
磷酸化:金属氧化物(TiO2)、酪氨酸抗体
泛素化/乙酰化:抗体
糖基化:凝集素
棕榈酰化/亚硝基化:生物素
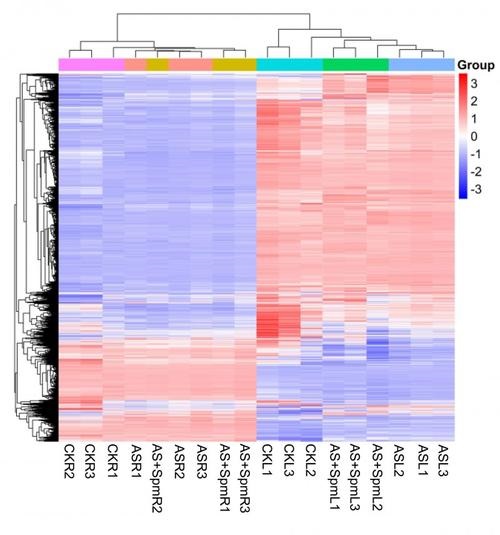
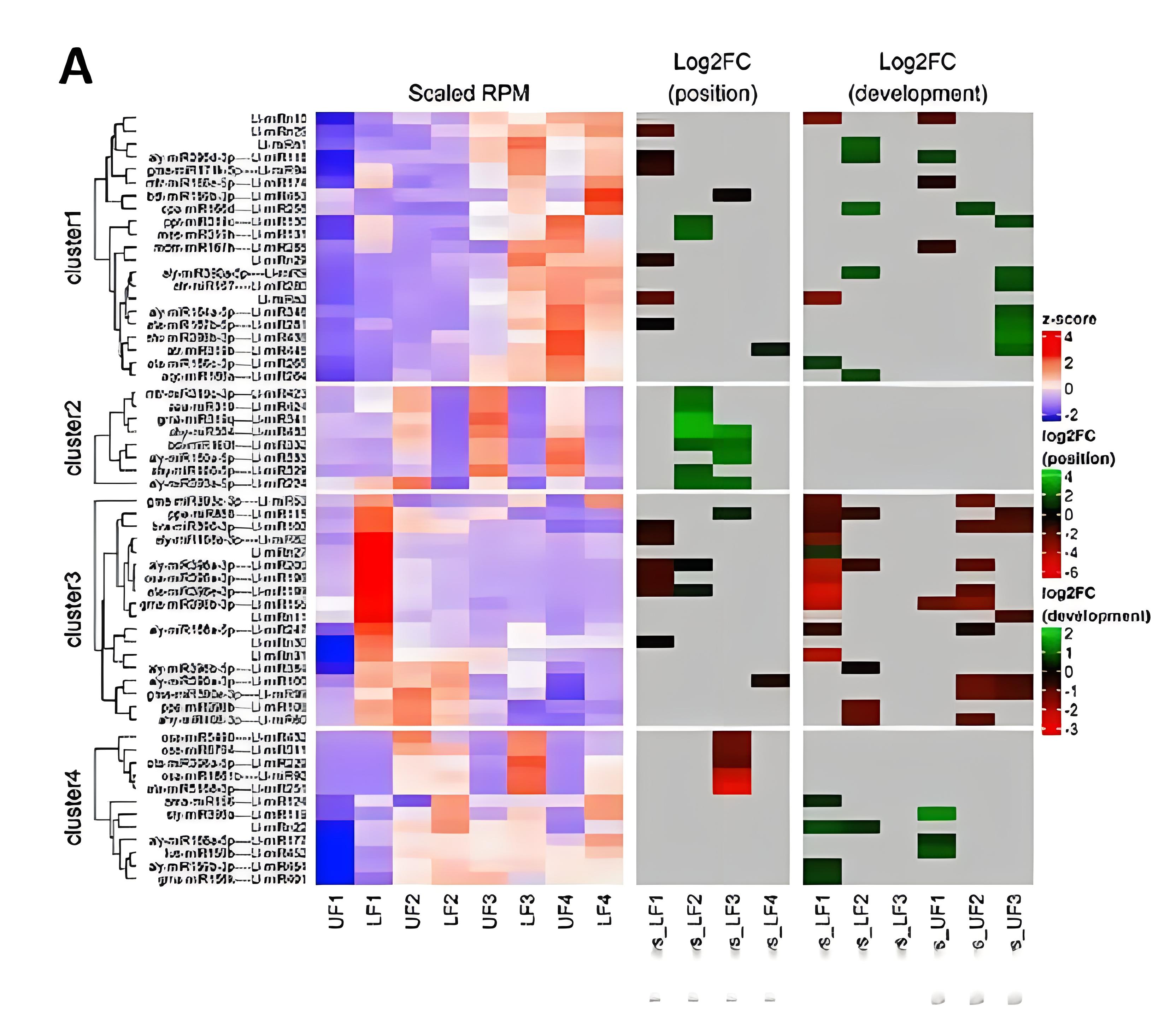
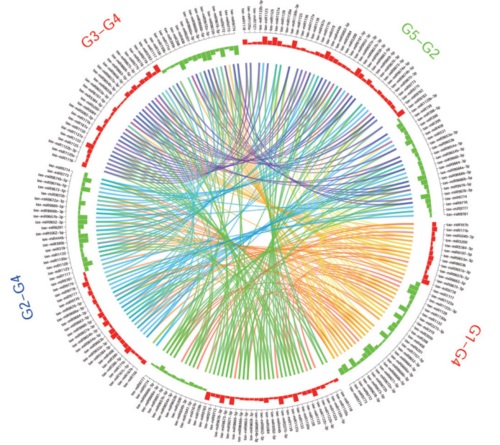
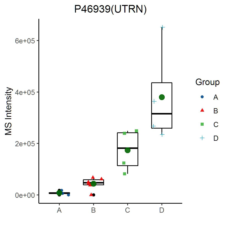
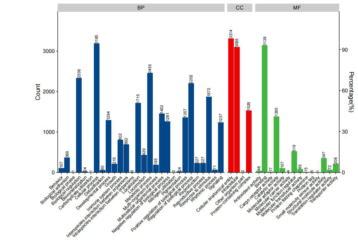
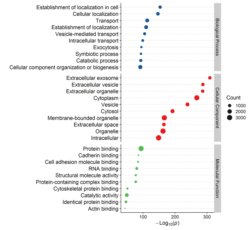
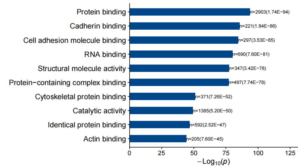
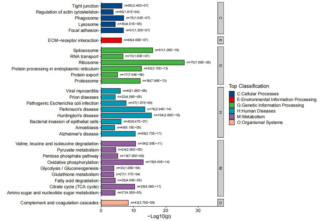
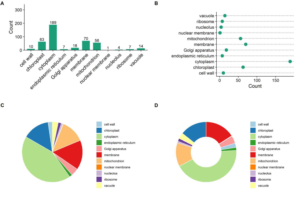
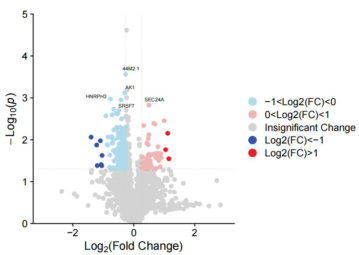
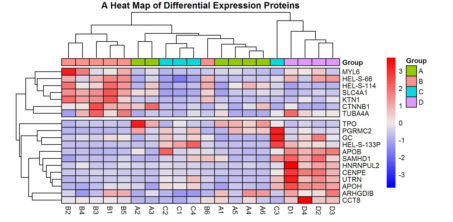
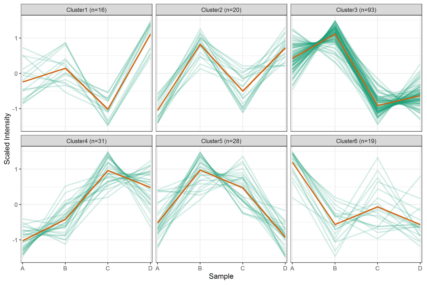
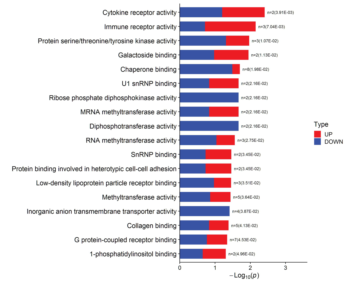
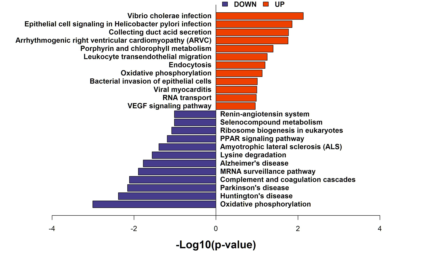
部分结果展示:

| 样品类型 | 送样量 | 预处理和保存 |
| 常规动物组织(脑、心、肝、脾、肺、肾、肌肉、皮肤等) | ≥30 mg | PBS洗涤去除残留血液和污染物,迅速剥去脂肪和筋皮等结缔组织,冲洗干净。用组织剪或手术刀将组织分离成1cm3左右的小块。液氮速冻,保存在-80°C,干冰运输 |
| 软体动物(血吸虫、旋毛虫等) | ≥200 mg | PBS洗涤去除来自宿主的污染。液氮速冻,保存在-80°C,干冰运输 |
| 动物软骨组织 | ≥100 mg | PBS洗涤,用手术刀将软骨切成1cm3左右的小块。液氮速冻,保存在-80°C,干冰运输 |
| 动物毛发 | ≥50 mg | 用适量2%SDS,50mM 磷酸钠(pH7.8)缓冲液漂洗样品,去除污染物,干燥,保存在-80°C,干冰运输 |
| 柔软组织(木本植物的叶、花等,草本科植物,藻类,蕨类植物,大型真菌等) | ≥50 mg | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 木本科植物的树根、树皮、树枝等 | ≥2 g | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 果实、种子 | ≥200 mg | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 果肉 | ≥2 g | 去皮切成1cm3左右小块,液氮速冻,保存于-80°C,干冰运输 |
| 花粉 | ≥10 mg | 植物开花期收集花粉,解剖显微镜下检查花粉,用解剖针去除花药碎片等杂质,转入EP管中,光学显微镜下检查花粉的形态和纯度。保存于-80°C,干冰运输 |
| 细菌菌类 | ≥20 mg | 3000g-5000g离心5-15min,去上清,PBS洗涤沉淀三次,液氮速冻,菌体-80°C保存,干冰运输 |
| 真菌菌体 | ≥2 g | PBS清洗,吸水纸吸去表面液体,液氮速冻,保存于-80°C,干冰运输 |
| 悬浮培养细胞 | ≥1*107 | 1)400g-1000g离心10分钟收获细胞,弃上清。 2)用预冷的PBS小心洗涤片状沉淀物2次,置于冰上,去上清。 3)液氮速冻,-80°C保存,干冰运输 |
| 贴壁培养细胞 | ≥1*107 | 1)弃掉培养液,并将培养皿倒置于吸水纸上吸干培养液 2) 加入4°C预冷的PBS,平放轻轻摇动1分钟洗涤细胞,然后弃去PBS。 重复以上操作两次以洗去培养液。 3)将培养皿置于冰上。向培养皿内加入4°C预冷的PBS。用干净的细胞刮棒将细胞刮于培养皿的一侧(动作要快),冰上斜置培养皿,使得缓冲液流向一侧。移液管吸取溶解产物至预冷的离心管内。离心去上清。 4)液氮速冻,-80°C保存,干冰运输 |
| 血清 | ≥50 μL | 收集好的全血室温静置两小时,3000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 血浆 | ≥50 μL | 收集好的全血加入抗凝剂,室温静止30分钟,1300g-2000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 动物乳汁或人乳汁 | ≥1mL | 收集母乳,-80°C保存,干冰运输。若要去除样品中的高丰度酪蛋白,需要超速离心除去。 |
| 乳脂肪球膜蛋白(MFGM),即脂质层 | ≥50 μL | 收集母乳,4度高速离心15min,取脂质层,用预冷的5倍体积的PBS洗涤3次,纯水洗涤一次,-80°C保存,干冰运输 |
| 脑脊液、关节液、淋巴液、附睾腔液 | ≥20 μL | 1000g-2000g离心5min,(或使用0.22µm滤膜过滤),取上清,-80°C保存,干冰运输 |
| 唾液 | ≥50 μL | 禁食两小时以上,9-12am取样,1000g-2000g离心5min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 泪液 | ≥100 μL | 收集样品(可利用capillary micropipette或Schirmer strip),8000-14000g 4度 离心5min,取上清, -80°C保存,干冰运输 |
| 尿液 | ≥5 mL | 5000×g 4°C 离心30-60min,取上清, -80°C保存,干冰运输 |
| 分泌蛋白-细胞分泌液 | ≥2 mL | 10000g-20000g离心30-60min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 分泌蛋白-脑组织分泌液 | ≥2 mL | 10000g-20000g离心30-60min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 分泌蛋白-间质液 | ≥50 μL | 样品收集,-80°C保存,干冰运输 |
| 外泌体-血清 | ≥2 mL | 收集好的全血室温静置两小时,3000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 外泌体-血清 | ≥2 mL | 收集好的全血加入抗凝剂,室温静止30分钟,1300g-2000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 外泌体-尿液 | ≥30 mL | 5000×g 4°C 离心30-60min,取上清, -80°C保存,干冰运输 |
| IP样品 | ≥20 μg | 样品洗脱时,建议采取酸性洗脱模式,wash buffer中不建议含有去垢剂(SDS,NP-40,Triton-X100),若需要使用去垢剂作为洗脱溶液,则需要采用SDS-PAGE对样本进行预处理,送样前,迅速液氮中速冻,并保存于-80°C中,干冰运输 |
样品制备:获取高质量的生物样品,如细胞、组织或体液。
蛋白质提取和纯化:从样品中提取蛋白质,去除杂质。
修饰位点鉴定:使用质谱、抗体或其他方法鉴定修饰的蛋白质及其位点。
功能分析:通过基因敲除、过表达、抑制剂等手段研究修饰对蛋白质功能的影响。
癌症研究:分析癌症细胞中的蛋白质修饰模式,寻找潜在的治疗靶点。
神经退行性疾病:研究蛋白质修饰在阿尔茨海默病、帕金森病等疾病中的作用。
代谢性疾病:分析蛋白质修饰如何影响胰岛素信号转导、脂肪代谢等过程。
修饰位点的多样性和复杂性:不同的修饰类型可以发生在同一个蛋白质的不同位点上,增加了研究的难度。
低丰度修饰的检测:某些修饰的丰度很低,难以用常规方法检测。
修饰的动态性和可逆性:许多修饰是动态变化的,需要研究其在不同时间和条件下的变化。
技术创新:开发更灵敏、更特异的检测方法,提高修饰位点的鉴定准确性和效率。
整合分析:将修饰蛋白组学与其他组学数据(如基因组学、转录组学、代谢组学等)整合分析,揭示蛋白质修饰在生物体中的综合作用。
临床应用:将修饰蛋白组学研究成果应用于疾病诊断和治疗,开发基于蛋白质修饰的新型药物和疗法。
1、什么是修饰蛋白组学?
修饰蛋白组学是研究生物体内蛋白质翻译后修饰(Post-translational modifications, PTMs)的科学领域。这些修饰包括磷酸化、泛素化、甲基化、乙酰化、糖基化等,可以显著影响蛋白质的功能、活性、定位或相互作用。
2、为什么要研究修饰蛋白组学?
修饰蛋白组学对于理解蛋白质功能、细胞信号转导、疾病发生机制等至关重要。许多疾病,如癌症、神经退行性疾病和代谢性疾病,都与蛋白质修饰的异常有关。
3、常见的蛋白质修饰有哪些?
常见的蛋白质修饰包括磷酸化、泛素化、甲基化、乙酰化、糖基化、SUMO化等。这些修饰可以发生在蛋白质的特定氨基酸残基上,如丝氨酸、苏氨酸、酪氨酸、赖氨酸等。
4、如何研究修饰蛋白组学?
研究修饰蛋白组学通常涉及以下几个步骤:
5、修饰蛋白组学在疾病研究中的应用有哪些?
修饰蛋白组学在疾病研究中的应用广泛,包括:
6、修饰蛋白组学面临哪些挑战?
修饰蛋白组学面临的挑战包括:
7、修饰蛋白组学的未来发展方向是什么?
修饰蛋白组学的未来发展方向包括: