一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请
方法简介
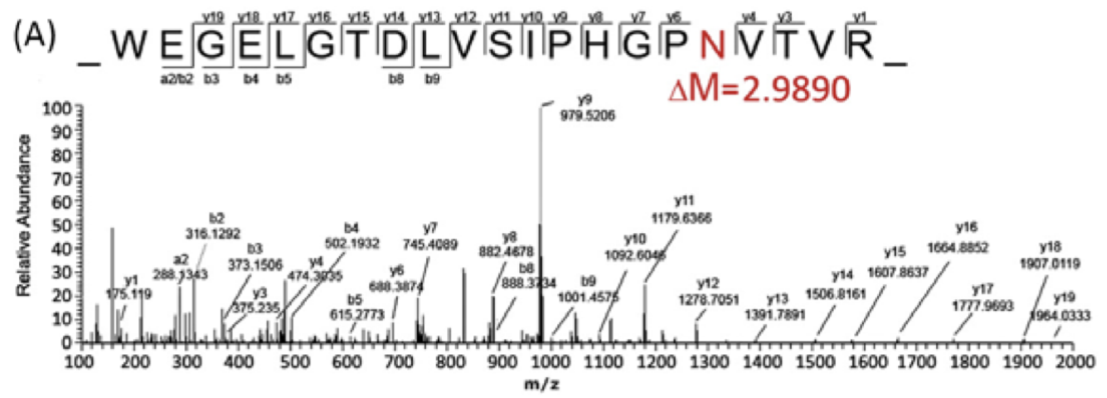
一般发生N-糖基化位点修饰的蛋白质,均有基本的氨基酸结构骨架。N-糖基化位点鉴定通常使用PNGase F酶释放糖链, 天冬酰胺(N)发生脱氨基化,为了避免天然脱氨基化造成的假阳性,在 18 O水中进行酶切, 使去糖基化位点含有一个18 O,形成+2.9890Da。通过高精度LC-MS/MS检测脱糖后肽段,确认脱糖后分子量与理论分子量的变化以及糖基化修饰肽段的序列,从而确定蛋白质的糖基化位点。

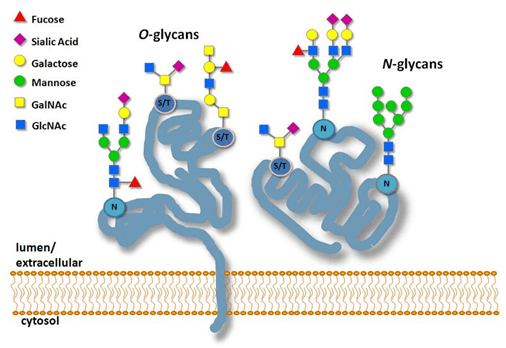
样品要求
关于样品:至少需要20ug的蛋白质,纯度>90% ;含盐量:挥发性无机盐<20mM,不挥发性无机盐<5mM;蛋白溶液避免SDS等变性剂,表面活性剂,不含tris缓冲体系。
样品运输:请使用足量的干冰运输,并尽量选用较快的邮递方式,以降低运输过程中样品降解的可能性。
N糖基化位点分析是蛋白质研究中的一项重要任务,它涉及到对蛋白质分子中特定氨基酸残基上连接的N糖基化位点的鉴定和分析。这种分析对于理解蛋白质的结构、功能以及其在生物体内的相互作用具有重要意义。
在N糖基化位点分析中,通常需要对糖基化位点进行特异的质量标记,使其与未修饰的蛋白质质量之间有一个特定的差异。然后,通过质谱分析来检测这种差异,并进一步通过串联质谱鉴定是在哪个氨基酸残基上发生了糖基化。
常用的方法之一是N-糖苷酶F(PNGase F)酶解法。PNGase F作为脱氨基酶,可以将原先糖基化的天冬酰胺脱氨基后转变为天冬氨酸,造成相对分子质量增加1。随后,通过质谱比较含有天冬氨酸的肽与含有非糖基化天冬酰胺的肽的相对分子质量,即可确定发生N-糖基化的氨基酸位点。
此外,质谱技术(如LC-MS/MS)在N糖基化位点分析中扮演着关键角色。这个过程通常包括蛋白质提取和纯化、酶解、质谱分析以及数据分析等步骤。首先,从细胞或组织样本中提取蛋白质并进行纯化。然后,使用特定的酶(如胰蛋白酶)将蛋白质分解成较小的肽段。接下来,利用液相色谱-串联质谱技术对这些肽段进行质谱分析,通过电离和检测肽段的质荷比来识别糖基化修饰的存在。最后,使用专门的软件对质谱数据进行分析,以鉴定N糖基化的特定位点。
N糖基化位点分析的结果对于生物药物的研发和生产具有重要意义。糖基化位点的位置影响着蛋白质的生物学活性、药效以及药物代谢和免疫反应。因此,准确地定位和分析N糖基化位点对于优化药物设计、提高药物稳定性以及预测药物的疗效和副作用至关重要。