一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请

ITRAQ标记定量蛋白质组学分析
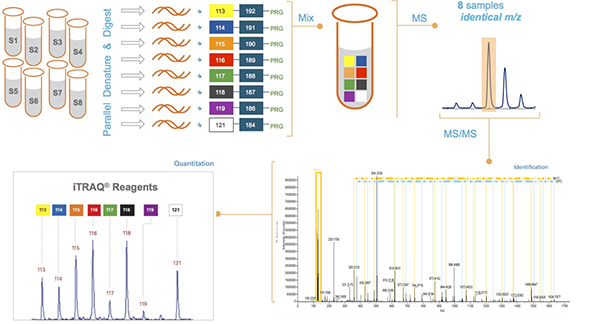
iTRAQ (Isobaric tag for relative and absolutequantitation, iTRAQ)是由AB SCIEX公司研发的一种体外同重同位素标记的相对与绝对定量技术。该技术利用4种或8种不同签的同位素试剂特异性地标记不同样品中的蛋白多肽氨基基团,标记的样品等量混匀后,经液相色谱分离及串联质谱(MS/M)分析,可同时比较4种或8种不同样品中蛋白质的相对表达量信息,通过生物信息学分析即可鉴定出所测蛋白及其在各样品中的表达差异 。
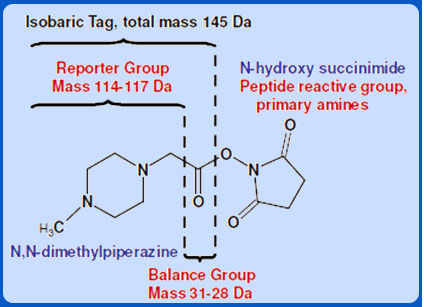
iTRAQ试剂由三部分组成:报告基团、质量平衡基团和反应标记试剂基团,形成4种或8种相对分子质量均等量(145或305)的异位标签iTRAQ试剂用于标记酶解后的肽段。在质谱中,任何一种iTRAQ试剂标记的不同样本中的同一肽段表现为相同的质荷比。在串联质谱中,报告基团、质量平衡基团和多反应基团之间的键断裂,质量平衡基团丢失,带不同同位素标签的同一多肽产生不同的报告离子,根据报告离子的信号强度可获得样品间相同肽段的定量信息,再经过软件处理得到蛋白质的定量信息。
技术特点:
1、灵敏度高:可检测出较低丰度蛋白,胞浆蛋白、膜蛋白、核蛋白、胞外蛋白等;
2、分离能力强:可分离出酸/碱性蛋白,小于10K或大于200K的蛋白、难溶性蛋白;
3、高通量:可同时对8个样本进行分析,特别适用于采用多种处理方式或来自多个处理时间的样本的差异蛋白分析;
4、结果可靠准确:定性与定量同步进行,同时得出鉴定和定量结果,重复样品间的蛋白表达量相关性可达到0.95以上;
5、兼容性高:标记所有的肽段,包括翻译后修饰,提高了蛋白质组的覆盖率,而且提高了鉴定和定量的可信度。
ITRAQ 标记定量流程:
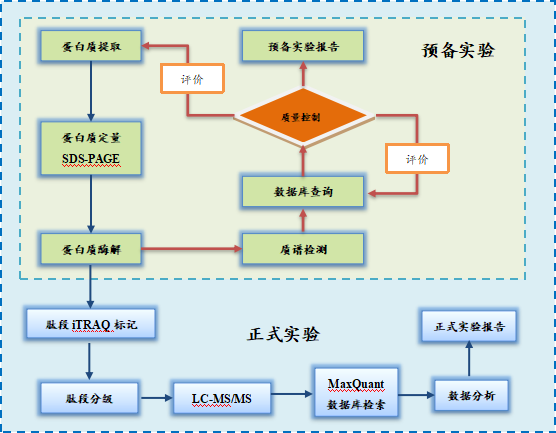
项目实验流程
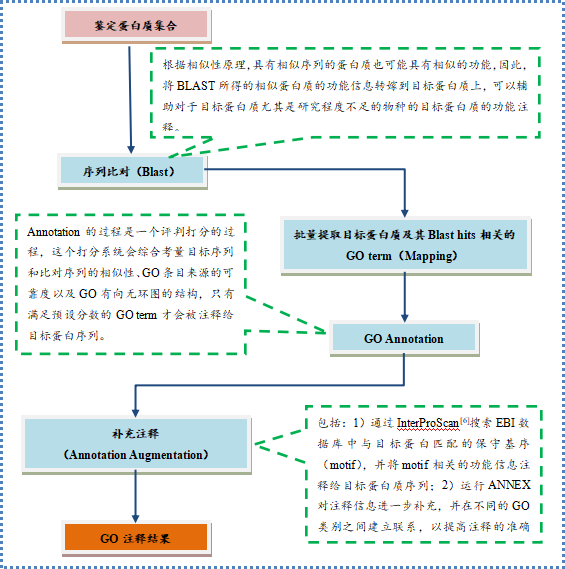
功能注释流程
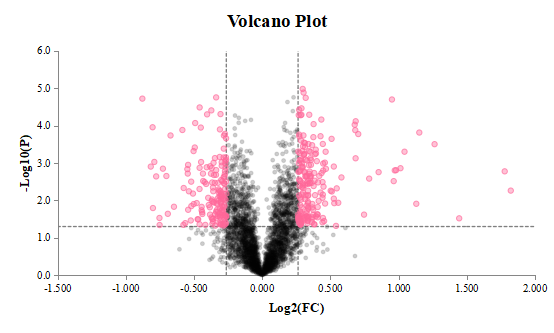
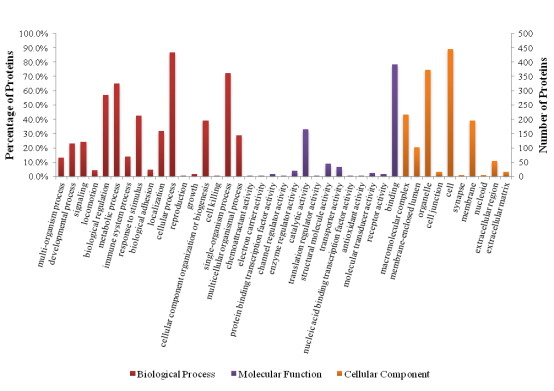
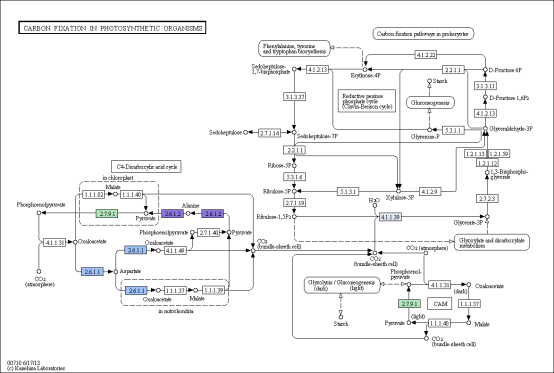
部分结果图展示
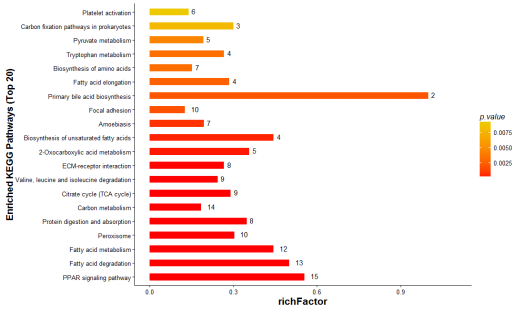
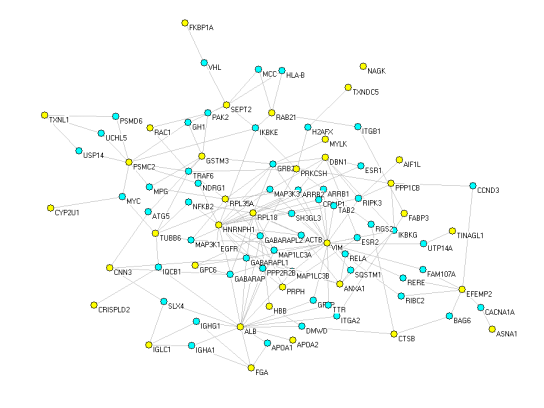
| 样品类型 | 送样量 | 预处理和保存 |
| 常规动物组织(脑、心、肝、脾、肺、肾、肌肉、皮肤等) | ≥50 mg | PBS洗涤去除残留血液和污染物,迅速剥去脂肪和筋皮等结缔组织,冲洗干净。用组织剪或手术刀将组织分离成1cm3左右的小块。液氮速冻,保存在-80°C,干冰运输 |
| 软体动物(血吸虫、旋毛虫等) | ≥500 mg | PBS洗涤去除来自宿主的污染。液氮速冻,保存在-80°C,干冰运输 |
| 动物软骨组织 | ≥200 mg | PBS洗涤,用手术刀将软骨切成1cm3左右的小块。液氮速冻,保存在-80°C,干冰运输 |
| 动物毛发 | ≥200 mg | 用适量2%SDS,50mM 磷酸钠(pH7.8)缓冲液漂洗样品,去除污染物,干燥,保存在-80°C,干冰运输 |
| 柔软组织(木本植物的叶、花等,草本科植物,藻类,蕨类植物,大型真菌等) | ≥100 mg | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 木本科植物的树根、树皮、树枝等 | ≥5 g | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 果实、种子 | ≥50 mg | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 果肉 | ≥5 g | 去皮切成1cm3左右小块,液氮速冻,保存于-80°C,干冰运输 |
| 花粉 | ≥10 mg | 植物开花期收集花粉,解剖显微镜下检查花粉,用解剖针去除花药碎片等杂质,转入EP管中,光学显微镜下检查花粉的形态和纯度。保存于-80°C,干冰运输 |
| 细菌菌类 | ≥50 mg | 3000g-5000g离心5-15min,去上清,PBS洗涤沉淀三次,液氮速冻,菌体-80°C保存,干冰运输 |
| 真菌菌体 | ≥5 g | PBS清洗,吸水纸吸去表面液体,液氮速冻,保存于-80°C,干冰运输 |
| 悬浮培养细胞 | ≥2×10^7 | 1)400g-1000g离心10分钟收获细胞,弃上清。 2)用预冷的PBS小心洗涤片状沉淀物2次,置于冰上,去上清。 3)液氮速冻,-80°C保存,干冰运输 |
| 贴壁培养细胞 | ≥2×10^7 | 1)弃掉培养液,并将培养皿倒置于吸水纸上吸干培养液 2) 加入4°C预冷的PBS,平放轻轻摇动1分钟洗涤细胞,然后弃去PBS。 重复以上操作两次以洗去培养液。 3)将培养皿置于冰上。向培养皿内加入4°C预冷的PBS。用干净的细胞刮棒将细胞刮于培养皿的一侧(动作要快),冰上斜置培养皿,使得缓冲液流向一侧。移液管吸取溶解产物至预冷的离心管内。离心去上清。 4)液氮速冻,-80°C保存,干冰运输 |
| 血清 | ≥100 μL | 收集好的全血室温静置两小时,3000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 血浆 | ≥100 μL | 收集好的全血加入抗凝剂,室温静止30分钟,1300g-2000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 动物乳汁或人乳汁 | ≥3 mL | 收集母乳,-80°C保存,干冰运输。若要去除样品中的高丰度酪蛋白,需要超速离心除去 |
| 乳脂肪球膜蛋白(MFGM),即脂质层 | ≥150 μL | 收集母乳,4度高速离心15min,取脂质层,用预冷的5倍体积的PBS洗涤3次,纯水洗涤一次,-80°C保存,干冰运输 |
| 脑脊液、关节液、淋巴液、附睾腔液 | ≥50 μL | 1000g-2000g离心5min,(或使用0.22µm滤膜过滤),取上清,-80°C保存,干冰运输 |
| 唾液 | ≥100 μL | 禁食两小时以上,9-12am取样,1000g-2000g离心5min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 泪液 | ≥300 μL | 收集样品(可利用capillary micropipette或Schirmer strip),8000-14000g 4度 离心5min,取上清, -80°C保存,干冰运输 |
| 尿液 | ≥10 mL | 5000×g 4°C 离心30-60min,取上清, -80°C保存,干冰运输 |
| 分泌蛋白-细胞分泌液 | ≥5 mL | 10000g-20000g离心30-60min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 分泌蛋白-脑组织分泌液 | ≥5 mL | 10000g-20000g离心30-60min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 分泌蛋白-间质液 | ≥100 μL | 样品收集,-80°C保存,干冰运输 |
| IP样品 | ≥50 μg | 样品洗脱时,建议采取酸性洗脱模式,wash buffer中不建议含有去垢剂(SDS,NP-40,Triton-X100),若需要使用去垢剂作为洗脱溶液,则需要采用SDS-PAGE对样本进行预处理,送样前,迅速液氮中速冻,并保存于-80°C中,干冰运输 |
解答:iTRAQ技术使用四种或八种同位素标记的试剂(iTRAQ 4-plex或iTRAQ 8-plex),这些试剂具有相同的分子量但不同的质量数。样品中的肽段被标记后,混合在一起进行质谱分析。由于标记试剂的质量数不同,质谱图上会出现不同的报告离子,通过比较这些报告离子的强度,可以定量不同样品中肽段的相对丰度,从而推算出蛋白质的定量信息。
解答:iTRAQ技术的优点包括高通量、高灵敏度、高准确性和可重复性。该技术可以同时分析多个样品,且标记过程简单快速,不需要额外的分离步骤。此外,iTRAQ技术还可以提供绝对定量信息,并且对于低丰度蛋白质的检测也具有较好的效果。
解答:在使用iTRAQ技术进行蛋白质组学研究时,需要注意样品的质量、标记效率、质谱分析的参数设置等问题。样品应尽可能纯净,以减少杂质对定量结果的干扰。标记效率会影响定量准确性,因此需要优化标记条件。此外,质谱分析过程中的参数设置也会影响定量结果的准确性和可靠性。
解答:iTRAQ技术与其他定量技术相比,具有一些独特的特点。例如,iTRAQ技术可以同时分析多个样品,而不需要分别对每个样品进行独立的质谱分析。此外,iTRAQ技术使用的是同位素标记,相对于其他标记技术(如荧光标记)具有更高的灵敏度和准确性。
解答:iTRAQ技术广泛应用于生物学、医学和药学等领域的研究。例如,该技术可以用于研究疾病发生发展过程中的蛋白质表达变化、药物作用机制的探索以及生物标志物的发现等。此外,iTRAQ技术还可以与其他组学技术(如基因组学、转录组学等)相结合,为全面解析生物过程和疾病机制提供有力支持。
iTRAQ(isobaric tags for relative and absolute quantitation)是一种同位素标记的相对和绝对定量技术,常用于蛋白质组学研究。该技术使用特定的化学标签标记不同样品中的肽段,并通过质谱分析比较标记肽段的强度来定量蛋白质。以下是关于iTRAQ蛋白组技术检测蛋白的一些常见疑问及其解答:
1、iTRAQ技术的工作原理是什么?
2、iTRAQ技术有哪些优点?
3、iTRAQ技术需要注意哪些问题?
4、iTRAQ技术与其他定量技术相比有何不同?
5、iTRAQ技术在哪些领域有应用?