一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请

所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
DNA结合染料法 | 基于探针的化学法 | 猝灭染料引物法 | |
|---|---|---|---|
举例 | SYBR Green I | TaqMan、分子信标、Scorpion和杂交探针 | Amplifluor和LUX荧光引物 |
基本原理 | 应用一种带有荧光的、非特异的DNA结合染料检测PCR过程中积累的扩增产物。 | 应用一个或多个荧光标记的寡核苷酸探针检测PCR扩增产物;依赖荧光能量共振传递(FRET)检测特异性扩增产物。 | 采用荧光标记引物扩增,从而使荧光标记基团直接掺入PCR扩增产物中;依赖荧光能量共振传递(FRET)。 |
特异性 | 检测所有双链DNA扩增产物,包括非特异反应产物,如引物二聚体。 | 仅检测特异性扩增产物。 | 检测特异性扩增产物及非特异反应产物,如引物二聚体。 |
应用 | DNA及RNA定量;基因表达验证 | DNA及RNA定量;基因表达验证;等位基因鉴别;SNP分型;病原体和病毒检测;多重PCR | |
优点 | 可对任何双链DNA进行定量;不需要探针,因此减少了实验设计及运转成本;适合于大量基因的分析;简单易用。 | 探针和目标片段的特异性结合产生荧光信号,因此减少了背景荧光和假阳性;探针可标记不同波长的荧光基团,用于多重PCR反应。 | |
缺点 | 由于染料可同时检测特异性及非特异性PCR产物,因此会产生假阳性;需要PCR后处理过程。 | 对于不同的靶序列需要合成不同的探针,原料成本较高。 | |
检测方法
1.SYBRGreenⅠ法:
在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
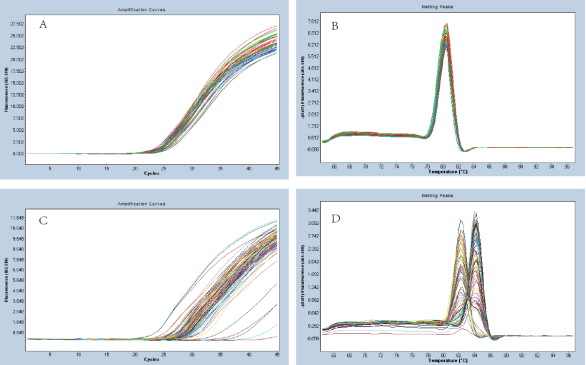
SYBR定量PCR扩增荧光曲线图
PCR产物熔解曲线图(单一峰图表明PCR扩增产物的单一性)
2.TaqMan探针法:
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物的形成完全同步。
技术原理
将标记有荧光素的Taqman探针与模板DNA混合后,完成高温变性,低温复性,适温延伸的热循环,并遵守聚合酶链反应规律,与模板DNA互补配对的Taqman探针被切断,荧光素游离于反应体系中,在特定光激发下发出荧光,随着循环次数的增加,被扩增的目的基因片段呈指数规律增长,通过实时检测与之对应的随扩增而变化荧光信号强度,求得Ct值,同时利用数个已知模板浓度的标准品作对照,即可得出待测标本目的基因的拷贝数。
Ct 值
Ct值(Cycle threshold,循环阈值)的含义为:每个反应管内的荧光信号到达设定阈值时所经历的循环数。
临床疾病诊断
各型肝炎、艾滋病、禽流感、结核、性病等传染病诊断和疗效评价;地中海贫血、血友病、性别发育异常、智力低下综合症、胎儿畸形等优生优育检测;肿瘤标志物及瘤基因检测实现肿瘤病诊断;遗传基因检测实现遗传病诊断。
动物疾病检测
禽流感、新城疫、口蹄疫、猪瘟、沙门菌、大肠埃希菌、胸膜肺炎放线杆菌、寄生虫病等、炭疽芽孢杆菌。
食品安全
食源微生物、食品过敏源、转基因、乳品企业阪崎肠杆菌等检测。
科学研究
医学、农牧、生物相关分子生物学定量研究。
应用行业
各级各类医疗机构、大学及研究所、CDC、检验检疫局、兽医站、食品企业及乳品厂等。
由于qPCR是实时定量检测致病病原体基因核酸,因此它比化学发光、时间分辨、蛋白芯片等免疫学方法更具独到优势。
1. 请提供已知的全长基因序列和详细背景资料:DNA/RNA来源,丰度;
2. 请您提供新鲜的且尽量多的材料,或直接提供纯化好的总RNA或DNA(大于5ug/样本)。
3. 动物组织:样本离体应当立即放入液氮或-80℃冰箱中速冻保存,避免反复冻融,并且样本在-80℃的保存时间不宜过长,若保存时间超过半年应及时与工作人员取得联系,组织寄送100mg以上,脂肪组织,结缔组织,纤维化组织适当增加,干冰运输;
4.植物:新鲜的叶、果肉、种子等最少需100mg,干冰运输。
5.细胞:1×10^6个细胞,加入trizol的细胞样本(不要直接运输加trizol的细胞培养皿),Trizol 为裂解液,不适用于组织样本的保存,细胞除外,干冰运输;
6.全血:最少1 mL新鲜血液EDTA抗凝管,4度运输; 血清:最少1 mL,干冰运输;
7.RNA样品: OD260/280为1.8-2.0,浓度≥100 ng/μL,体积≥20μL,干冰运输;cDNA:cDNA原液≥20 μL,干冰运输;
8. 对于完成实验后,剩余样本需要返还的项目,需在收到项目完整版结题报告一个月内告知公司,逾期样本将安排清理。
Q1、1.无Ct值出现
检测荧光信号的步骤有误:一般SybrGreen法采用72℃延伸时采集,Taqman法则一般在退火结束时或延伸结束采集信号。
1、引物或探针降解:可通过PAGE电泳检测其完整性。
2、模板量不足:对未知浓度的样品应从系列稀释样本的最高浓度做起。
3、模板降解:避免样品制备中杂质的引入及反复冻融的情况。
Q2、2.Ct值出现过晚(Ct>38)
1、扩增效率低:反应条件不够优化。设计更好的引物或探针;改用三步法进行反应;适当降低退火温度;增加镁离子浓度等。
2、PCR各种反应成分的降解或加样量的不足。
3、PCR产物太长:一般采用80-150bp的产物长度。
Q3、3.溶解曲线不止一个主峰
1、引物设计不够优化:应避免引物二聚体和发夹结构的出现。
2、引物浓度不佳:适当降低引物的浓度,并注意上下游引物的浓度配比。
3、镁离子浓度过高:适当降低镁离子浓度,或选择更合适的mix试剂盒。
4、模板有基因组的污染:RNA提取过程中避免基因组DNA的引入,或通过引物设计避免非特异扩增。
Q4、4.扩增效率低
1、反应试剂中部分成分特别是荧光染料降解。
2、反应条件不够优化:可适当降低退火温度或改为三步扩增法。
3、反应体系中有PCR反应抑制物:一般是加入模板时所引入,应先把模板适度稀释,再加入反应体系中,减少抑制物的影响。