一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请
ELISA方法的基本原理是酶分子与抗体或抗抗体分子共价结合,此种结合不会改变抗体的免疫学特性,也不影响酶的生物学活性。此种酶标记抗体可与吸附在固相载体上的抗原或抗体发生特异性结合。滴加底物溶液后,底物可在酶作用下使其所含的供氢体由无色的还原型变成有色的氧化型,出现颜色反应。因此,可通过底物的颜色反应来判定有无相应的免疫反应,颜色反应的深浅与标本中相应抗体或抗原的量呈正比。此种显色反应可通过ELISA检测仪进行定量测定,这样就将酶化学反应的敏感性和抗原抗体反应的特异性结合起来,使ELISA方法成为一种既特异又敏感的检测方法。
如今ELISA方法已被广泛应用于多种细菌和病毒等疾病的诊断。在动物检疫方面,ELISA在猪传染性胃肠炎、牛副结核病、牛传染性鼻气管炎、猪伪狂犬病、蓝舌病等的诊断中已为广泛采用的标准方法。
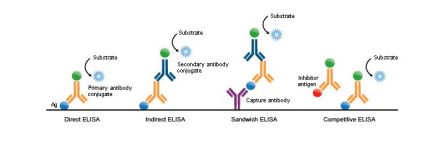
根据ELISA所用的固相载体而区分为三大类型:一是采用聚苯乙烯微量板为载体的ELISA,即我们通常所指的ELISA(微量板ELISA);另一类是用硝酸纤维膜为载体的ELISA,称为斑点ELISA(Dot-ELISA);再一类是采用疏水性聚脂布作为载体的ELISA,称为布ELISA(C-ELISA)。在微量板ELISA中,又根据其性质不同分为间接ELISA、双抗体夹心ELISA、双夹心ELISA、竞争ELISA、阻断ELISA及抗体捕捉ELISA。
间接ELISA
本法主要用于检测抗体。以鸭病毒性肝炎(DVH)抗体的ELISA为例,间接ELISA的操作程序如下。
⑴ 材料
① 包被液、洗涤液、保温液、底物液、终止液;
② DVH包被抗原、酶标抗抗体、阴性及阳性DVH参考血清;待检鸭血清;
③ ELISA检测仪、加样器、聚苯乙烯微量板。
⑵ 方法步骤
① 加抗原包被 → 4℃过夜,洗涤三次、抛干
② 加待检血清 → 37℃ 2小时,洗涤三次、抛干
③ 加酶标抗体 → 37℃ 2小时,洗涤三次、抛干
④ 加底物液 → 37℃ 30分钟,加终止液
⑤ 用ELISA检测仪测定OD值,并计算出P/N比值。
⑶ 结果判定 已知阳性血清与已知阴性血清的比值(P/N)≥2.1,而且已知阳性血清的OD值≥0.4;在上述条件成立的情况下,如果待检血清与已知阴性血清的比值(P/N)≥2.1,而且待检血清的OD值≥0.4,则判为阳性,否则判为阴性。
双抗体夹心
本法主要用于检测大分子抗原。现以检测鸡传染性法氏囊病病毒(IBDV)的双夹心抗体ELISA为例介绍本法的操作程序。
① 加抗体包被 → 4℃过夜,洗涤三次、抛干
② 加待检抗原 → 37℃ 30分钟,洗涤三次、抛干
③ 加酶标抗体 → 37℃ 30分钟,洗涤三次、抛干
④ 加底物液 → 37℃ 15分钟,加终止液
⑤ 用ELISA检测仪测定OD值。
双夹心ELISA
此法与双抗体夹心ELISA的主要区别在于:它是采用酶标抗抗体检查多种大分子抗原,它不仅不必标记每一种抗体,还可提高试验的敏感性。此法的基本程序为:
① 加抗体(Ab-1)包被 → 4℃过夜,洗涤三次、抛干
② 加待检抗原(Ag) → 37℃ 60分钟,洗涤三次、抛干
③ 加用非同种动物生产的特异性抗体(Ab-2)→ 37℃ 60分钟,洗涤三次、抛干
④ 加入酶标抗Ab-2抗体(AB-3)→ 37℃ 60分钟,洗涤三次、抛干
⑤ 加底物液 → 37℃ 20分钟,加终止液
⑥ 用ELISA检测仪测定OD值。
竞争ELISA
此法主要用于测定小分子抗原及半抗原,其原理类似于放射免疫测定。其基本程序为:
① 抗体包被 → 4℃过夜,洗涤三次、抛干
② 加入待检抗原及一定量的酶标抗原(对照孔仅加酶标抗原)→ 37℃ 60分钟,洗涤三次、抛干
③ 加底物液 → 37℃ 20分钟,加终止液
④ 用ELISA检测仪测定OD值。
被结合的酶标抗原的量由酶催化底物反应产生有色产物的量来确定,如果待检溶液中抗原越多,被结合的标记抗原的量就越少,有色产物就减少,这样根据有色产物的变化就可求出未知抗原的量。此法的优点在于快速、特异性高、且可用于小分子抗原及半抗原的检测;其主要不足在于每种抗原都要进行酶标记,而且因为抗原的结构不同,还需应用不同的结合方法。此外,试验中应用酶标抗原的量较多。
阻断ELISA
本法主要用于检测型特异性抗体。该方法现已成为猪传染性胃肠炎(TGE)、猪伪狂犬病(PR)及猪胸膜肺炎(AP)的主要检测方法。下面以AP2型抗体的阻断ELISA检测法为例介绍其操作程序:
① 100μl AP2型工作量抗原包被 → 4℃过夜,洗涤三次、抛干
② 用200μl阻断缓冲液进行封闭 → 37℃ 60分钟,洗涤三次、抛干
③ 加工作量1:4稀释被检猪血清100μl → 37℃ 60分钟,洗涤三次、抛干
④ 加100μl工作量兔抗AP2型血清 → 37℃ 30分钟,洗涤三次、抛干
⑤ 加100μl工作量猪抗兔IgG-HRP → 37℃ 60分钟,洗涤三次、抛干
⑥ 加100μl OPD底物液 → 37℃ 20分钟,加终止液
⑦ 用ELISA检测仪测定OD值。
本试验同时设标准阴、阳性血清对照、兔抗AP2型阳性对照、空白对照。
抗体捕捉ELISA
本法主要用于检测IgM抗体。由于IgM抗体出现于感染早期,所以检测出IgM,则可作为某种疾病的早期诊断。抗体捕捉ELISA根据所用标记方式不同可分为标记抗原、标记抗体、标记抗抗体捕捉ELISA等几种,其中以标记抗原捕捉ELISA比较有代表性,该方法的主要程序为:
① 用抗u链(抗IgM重链)抗体包被→37℃ 60分钟后置4℃过夜,洗涤三次、抛干
② 加待检血清 → 37℃ 2小时,洗涤三次、抛干
③ 加酶标抗原 → 37℃ 60分钟,洗涤三次、抛干
④ 加底物液 → 37℃ 20分钟,加终止液
⑤ 用ELISA检测仪测定OD值。
斑点ELISA
与常规的微量板ELISA比较,Dot-ELISA具有简便、节省抗原等优点,而且结果可长期保存;但其也有不足,主要是在结果判定上比较主观,特异性不够高等。该方法的主要操作程序为:
⑴载体膜的预处理及抗原包被 取硝酸纤维素膜用蒸馏水浸泡后,稍加干燥进行压圈。将阴性、阳性抗原及被检测抗原适度稀释后加入圈中,置37℃使硝酸纤维素膜彻底干燥。每张7cm×2.3cm的膜一般可点加40-53个样品,每个压圈可加抗原液1-20μl。
⑵ 封闭 将硝酸纤维素膜置于封闭液中,37℃感作15-30分钟。封闭液多采用含有正常动物血清、pH7.2或pH7.4的PBS。
⑶ 加被检血清 可直接在抗原圈上加,也可剪下抗原圈、置于微量板孔中,再加入一定量适度稀释的待检血清,37℃反应一定时间,用洗涤液洗三次,每次1-3分钟。洗涤液一般为一定浓度的PBS-Tween溶液。
⑷ 加酶标抗体,37℃反应一定时间后,用洗涤液洗三次。
⑸显色 加入新鲜配制的底物液,37℃反应一定时间后,去掉底物液,加蒸馏水洗涤终止反应。
⑹ 结果判定 以阳性、阴险血清作为对照,膜片中央出现深棕红色斑点者为阳性反应,否则为阴性反应。
布ELISA
(C-ELISA) C-ELISA(Cloth-ELISA)是加拿大学者Blais,B. W.等于1989年建立的一种新型免疫检测技术。该方法是以疏水性聚脂布(Hydrophobic Polyester Cloth)即涤纶布为固相载体,这种大孔径的的疏水布具有吸附样品量大,可为免疫反应提供较大的表面积,提高反应的敏感性,且容易洗涤,不需特殊仪器等优点。其基本原理与Dot-ELISA类似,只是载体不同。以对布氏杆菌抗原的检测为例,C-ELISA的主要程序为:
⑴ 首先把抗布氏杆菌的血清包被(吸附)在聚脂布上,并经洗涤及封闭;
⑵ 加被检样品并于室温下感作30分钟,然后洗5次;
⑶ 加酶标记的抗布氏杆菌抗体,于室温下感作30分钟,然后洗涤5次;
⑷ 加入底物液显色;
⑸ 测定OD值。

1 待测指标的试剂盒(也可以由公司代购);
2. 待测的样品如果不能及时检测,请将样品保存于-20℃或按照相应说明书要求进行保存,长期保存于-80℃,尽量避免反复冻融。
可能原因:血清标本中存在非特异性抗体或蛋白质干扰。
解决方案:进行去除非特异性抗体的处理,或增加阴性对照孔的数量以反映实验背景噪声。
可能原因:实验操作不一致,或存在人为误差。
解决方案:规范实验操作流程,采用自动化设备减少误差,并对实验数据进行严格的质量控制。
可能原因:标准品溶液浓度不准确,酶标仪误差,或抗体浓度不均匀。
解决方案:确保标准品溶液浓度准确,定期校准和维护酶标仪,采用多点校准曲线。
可能原因:抗体和抗原的结合能力较弱,或酶标仪灵敏度较低。
解决方案:优化抗体和抗原的结合条件,采用高灵敏度的酶标仪和检测系统,增加样本浓度和检测次数。
可能原因:漏加底物成分,底物失效,或抗原抗体不匹配。
解决方案:检查底物成分和浓度,确保抗原抗体匹配,避免样品稀释过度。
可能原因:酶标抗原或抗体浓度过高,封闭试剂不正确,或酶标抗原抗体与体系中其他试剂结合。
解决方案:降低酶标抗原或抗体浓度,使用正确的封闭试剂,避免酶标抗原抗体与体系中其他试剂结合。
可能原因:酶标板质量问题,包被或加样过程中存在误差,加样时带入气泡等。
解决方案:检查酶标板均一性,规范包被和加样过程,避免带入气泡,确保试剂充分混匀。
可能原因:酶标抗原或抗体浓度过高或过低,试剂被污染,反应温度过低或底物缓冲液pH不正确等。
解决方案:调整酶标抗原或抗体浓度,确保试剂质量,控制反应温度和底物缓冲液pH。
可能原因:酶标抗原或抗体浓度过高,抗体非特异性结合,抗原或抗体不纯等。
解决方案:降低酶标抗原或抗体浓度,减少非特异性结合,确保抗原抗体纯度。
1、阴性对照孔与空白孔的OD值偏高:
2、重复孔之间差异较大:
2、标准曲线线性关系不佳:
4、灵敏度低:
5、显色极浅或不显色:
6、全板阳性:
7、不均匀显色:
8、显色过快或过慢:
9、背景深: