一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请
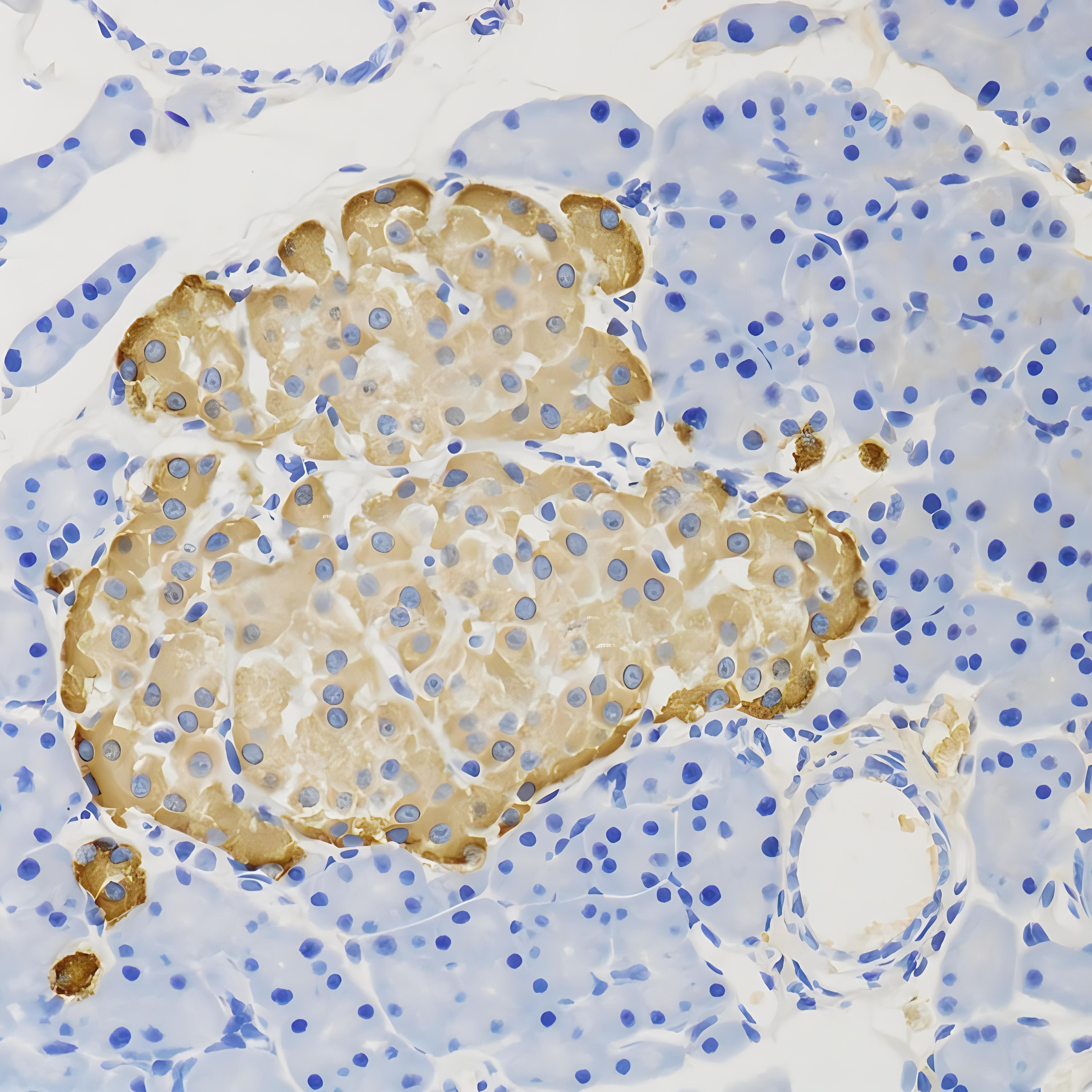
免疫组化,是应用免疫学基本原理——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究,称为免疫组织化学技术(immunohistochemistry)或免疫细胞化学技术(immunocytochemistry)。
抗体和抗原之间的结合具有高度的特异性,免疫组织化学正是利用了这一原理。先将组织或细胞中的某种化学物质提取出来,以此作为抗原或半抗原,通过免疫动物后获得特异性的抗体,再以此抗体去探测组织或细胞中的同类的抗原物质。由于抗原与抗体的复合物是无色的,因此还必须借助于组织化学的方法将抗原抗体结合的部位显示出来,以期达到对组织或细胞中的未知抗原进行定性,定位或定量的研究。
免疫组织化学技术按照标记物的种类可分为免疫荧光法、免疫酶法、免疫铁蛋白法、免疫金法及放射免疫自显影法等。
这些常用免疫组织化学方法的原理如下:
1. 免疫荧光细胞化学技术
将已知抗体标上荧光素,以此作为探针检查细胞或组织内的相应抗原,在荧光显微镜下观察.当抗原抗体复合物中的荧光素受激发光的照射后会发出一定波长的荧光,从而可以确定组织中的抗原定位或定量.
2. 免疫酶细胞化学技术
是免疫组织化学研究中最常用的技术.基本原理是先以酶标记的抗体与组织或细胞作用,然后加入酶的底物,生成有色的不溶性产物或具有一定电子密度的颗粒,通过光镜或电镜,对细胞或组织内的相应抗原进行定位或定性研究.
3. 免疫胶体金技术
就是用胶体金标记一抗,二抗或其他的能特异性的结合免疫球蛋白的分子(如葡萄球菌A蛋白)等作为探针对组织或细胞内的抗原进行定性,定位或定量研究.由于胶体金的电子密度高,多用于免疫电镜的单标记或多标记的定位研究.
标本
实验所用主要为组织标本和细胞标本两大类,前者包括石蜡切片(病理切片和组织切片)和冰冻切片,后者包括组织印片、细胞爬片和细胞涂片。
其中石蜡切片是制作组织标本最常用、最基本的方法,对于组织形态保存好,且能作连续切片,有利于各种染色对照观察;还能长期存档,供回顾性研究;石蜡切片制作过程对组织内抗原暴露有一定的影响,但可进行抗原修复,是免疫组化中首选的组织标本制作方法。
抗体
免疫组化实验中常用的抗体为单克隆抗体和多克隆抗体,单克隆抗体是一个B淋巴细胞克隆分泌的抗体,应用细胞融合杂交瘤技术免疫动物制备。多克隆抗体是将纯化后的抗原直接免疫动物后,从动物血中所获得的免疫血清,是多个B淋巴细胞克隆所产生的抗体混合物。
常用染色方法
根据标记物的不同分为免疫荧光法,免疫酶标法,亲和组织化学法,后者是以一种物质对某种组织成分具有高度亲合力为基础的检测方法。这种方法敏感性更高,有利于微量抗原(抗体)在细胞或亚细胞水平的定位,其中生物素—抗生物素染色法最常用。
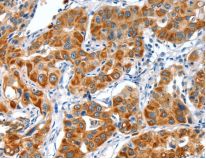
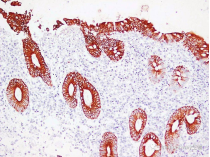
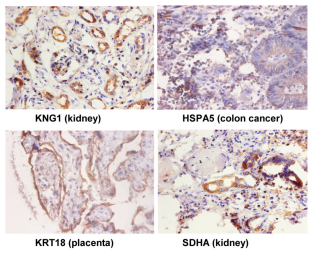
免疫组化项目测试结果,与样品处理、样品保存、一抗抗体质量有很大关系,若样品过多,请先做预实验看看效果后,再全部送样。我们可提供冰袋,但干冰需客户自己提供,或收取一定干冰费用。
背景染色:背景染色是指在非特异性区域出现的染色,这可能是由于抗体浓度过高、孵育时间过长、组织处理不当或试剂质量问题等原因引起的。为了减少背景染色,可以尝试降低抗体浓度、缩短孵育时间、优化组织处理或使用特异性更强的抗体。
非特异性染色:非特异性染色是指抗体与组织中的非目标抗原结合,导致在错误的位置出现染色。这可能是由于抗体特异性不足、组织处理不当或试剂交叉反应等原因引起的。为了避免非特异性染色,可以选择特异性更强的抗体、优化组织处理或使用阻断剂来减少非特异性结合。
染色强度不一致:在进行免疫组化实验时,可能会出现不同组织切片或同一组织切片不同区域之间的染色强度不一致。这可能是由于组织处理不一致、抗体浓度或孵育时间不稳定等原因引起的。为了解决这个问题,可以确保实验流程的标准化和一致性,包括组织处理、抗体浓度和孵育时间等参数的稳定性。
脱片:脱片是指在染色过程中组织从载玻片上脱落。这可能是由于组织固定不牢、载玻片处理不当或染色过程中的操作问题引起的。为了防止脱片,可以使用粘附剂处理载玻片、优化组织固定和染色过程中的操作技巧。
抗原丢失:抗原丢失是指在组织处理过程中目标抗原的丢失。这可能是由于组织固定不及时、固定液选择不当或固定时间过长等原因引起的。为了减少抗原丢失,可以尽快固定组织、选择合适的固定液和固定时间,并在组织处理过程中避免过度洗涤和高温处理。
免疫组化(IHC)是一种常用的实验技术,用于检测组织或细胞中的特定抗原。然而,在进行免疫组化实验时,可能会遇到一些常见问题。以下是一些常见的免疫组化问题及其可能的原因和解决方案: