一对一为您答疑解惑
立即扫码咨询
联系电话:15884474332
 专业可信赖 · 硕博顾问团队
专业可信赖 · 硕博顾问团队 信用支付 · 先测试后付费
信用支付 · 先测试后付费 高性价比 · 保质又低价
高性价比 · 保质又低价 做实验送积分 · 兑换海量好礼
做实验送积分 · 兑换海量好礼 报销无忧 · 正规合同发票
报销无忧 · 正规合同发票 可提供报告 · 可申请
可提供报告 · 可申请

标记定量蛋白质组学(Quantitative Proteomics by TMT)
TMT是由Thermo Scientific公司研发出来的一种试剂,有两种不同的多标组合试剂,非标为TMT6标和TMT10标。TMT试剂是由三部分组成:报告基团(6标实验相对分子质量分别为126、127、128、129、130和131;10标实验相对分子质量分别为126、127N、127C 、128N、128C 、129N、129C 、130N、130C 和131),质量平衡基团和肽反应标记试剂基团。
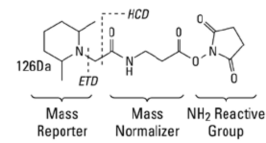
在串联质谱分析中,报告基团、质量平衡基团和多肽反应基团之间的键断裂,质量平衡基团丢失,带不同同位素标签的同一多肽产生4种或8种不同质量的报告离子,根据报告离子的丰度可获得样品间相同肽段的定量信息,再经过软件处理得到蛋白质的定量信息。近年来,TMT定量蛋白质组学技术已经成为一种非常重要的质谱定量方法,其基本技术路线如下图
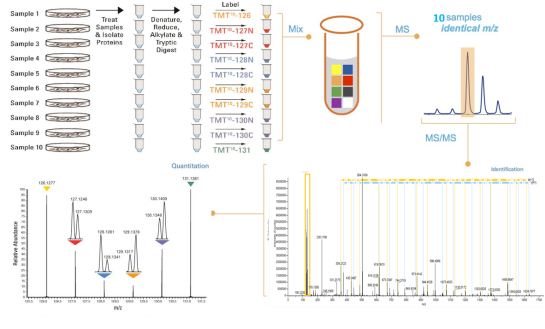
项目实验流程
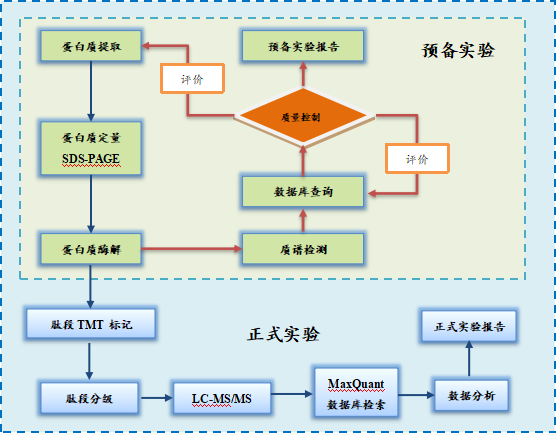
TMT标记定量蛋白质组学项目的主要步骤包括:蛋白质提取、蛋白质定量、蛋白质酶解、肽段TMT标记、LC-MS/MS分析、数据库检索、数据分析和实验报告等。
本项目流程分为预备实验和正式实验两部分:预备实验包括蛋白质提取、蛋白质定量、SDS-PAGE凝胶电泳、蛋白质酶解、质谱分析、数据库查询、质量控制以及出具预备实验报告等步骤;正式实验是在预备实验的基础上进行的,对预备实验中质控合格的样本继续进行肽段TMT标记、肽段分级以及采用高分辨质谱仪进行LC-MS/MS检测,对获得的质谱数据进行数据分析并出具正式实验报告。
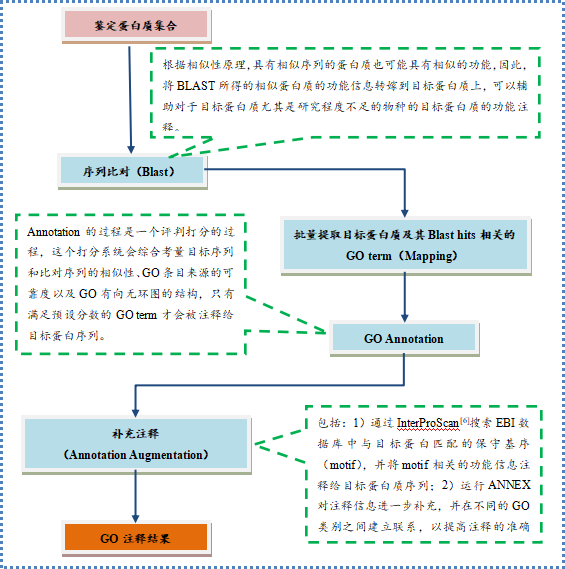
功能注释
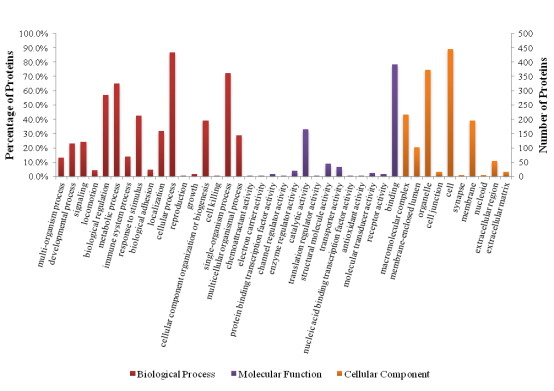
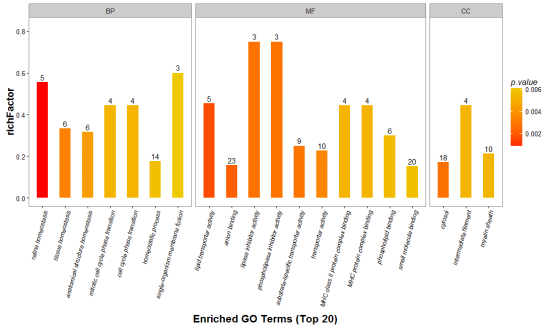
基因本体(Gene Ontology)是一个标准化的基因功能分类体系,提供了一套动态更新的标准化词汇表,并以此从三个方面描述生物体中基因和基因产物的属性:参与的生物过程(Biological Process),分子功能(Molecular Function)和细胞组分(Cellular Component)。通常情况下,对目标蛋白集合的GO功能注释的步骤和流程大致可以归纳如下图:
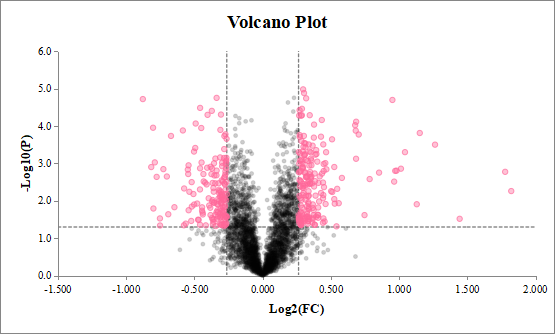
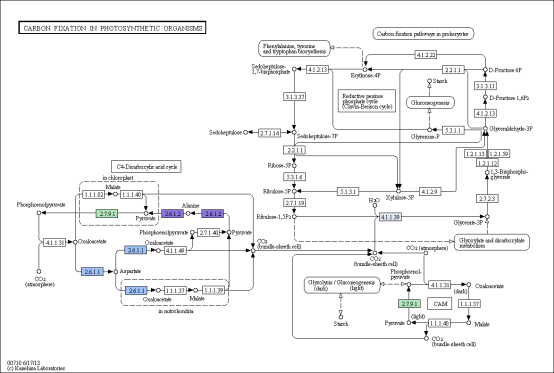
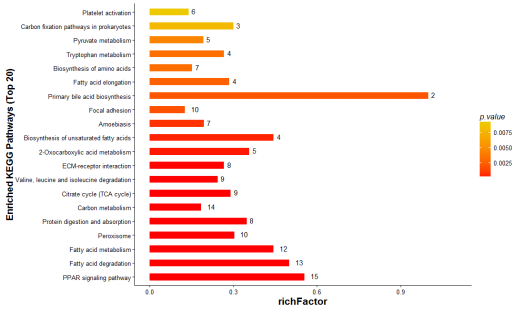
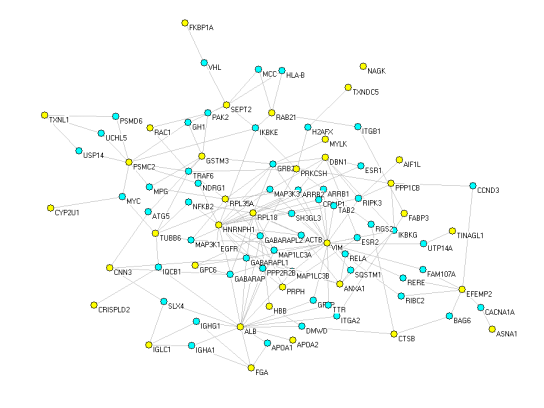
部分结果展示
| 样品类型 | 送样量 | 预处理和保存 |
| 常规动物组织(脑、心、肝、脾、肺、肾、肌肉、皮肤等) | ≥50 mg | PBS洗涤去除残留血液和污染物,迅速剥去脂肪和筋皮等结缔组织,冲洗干净。用组织剪或手术刀将组织分离成1cm3左右的小块。液氮速冻,保存在-80°C,干冰运输 |
| 软体动物(血吸虫、旋毛虫等) | ≥500 mg | PBS洗涤去除来自宿主的污染。液氮速冻,保存在-80°C,干冰运输 |
| 动物软骨组织 | ≥200 mg | PBS洗涤,用手术刀将软骨切成1cm3左右的小块。液氮速冻,保存在-80°C,干冰运输 |
| 动物毛发 | ≥200 mg | 用适量2%SDS,50mM 磷酸钠(pH7.8)缓冲液漂洗样品,去除污染物,干燥,保存在-80°C,干冰运输 |
| 柔软组织(木本植物的叶、花等,草本科植物,藻类,蕨类植物,大型真菌等) | ≥100 mg | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 木本科植物的树根、树皮、树枝等 | ≥5 g | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 果实、种子 | ≥50 mg | 收集样品,液氮速冻(如果样品表面有泥土或明显污染物,则液氮速冻前用PBS清洗,吸水纸吸去表面液体),保存在-80°C,干冰运输 |
| 果肉 | ≥5 g | 去皮切成1cm3左右小块,液氮速冻,保存于-80°C,干冰运输 |
| 花粉 | ≥10 mg | 植物开花期收集花粉,解剖显微镜下检查花粉,用解剖针去除花药碎片等杂质,转入EP管中,光学显微镜下检查花粉的形态和纯度。保存于-80°C,干冰运输 |
| 细菌菌类 | ≥50 mg | 3000g-5000g离心5-15min,去上清,PBS洗涤沉淀三次,液氮速冻,菌体-80°C保存,干冰运输 |
| 真菌菌体 | ≥5 g | PBS清洗,吸水纸吸去表面液体,液氮速冻,保存于-80°C,干冰运输 |
| 悬浮培养细胞 | ≥2×10^7 | 1)400g-1000g离心10分钟收获细胞,弃上清。 2)用预冷的PBS小心洗涤片状沉淀物2次,置于冰上,去上清。 3)液氮速冻,-80°C保存,干冰运输 |
| 贴壁培养细胞 | ≥2×10^7 | 1)弃掉培养液,并将培养皿倒置于吸水纸上吸干培养液 2) 加入4°C预冷的PBS,平放轻轻摇动1分钟洗涤细胞,然后弃去PBS。 重复以上操作两次以洗去培养液。 3)将培养皿置于冰上。向培养皿内加入4°C预冷的PBS。用干净的细胞刮棒将细胞刮于培养皿的一侧(动作要快),冰上斜置培养皿,使得缓冲液流向一侧。移液管吸取溶解产物至预冷的离心管内。离心去上清。 4)液氮速冻,-80°C保存,干冰运输 |
| 血清 | ≥100 μL | 收集好的全血室温静置两小时,3000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 血浆 | ≥100 μL | 收集好的全血加入抗凝剂,室温静止30分钟,1300g-2000g离心10min,取上清,液氮速冻,-80°C保存,干冰运输 |
| 动物乳汁或人乳汁 | ≥3 mL | 收集母乳,-80°C保存,干冰运输。若要去除样品中的高丰度酪蛋白,需要超速离心除去 |
| 乳脂肪球膜蛋白(MFGM),即脂质层 | ≥150 μL | 收集母乳,4度高速离心15min,取脂质层,用预冷的5倍体积的PBS洗涤3次,纯水洗涤一次,-80°C保存,干冰运输 |
| 脑脊液、关节液、淋巴液、附睾腔液 | ≥50 μL | 1000g-2000g离心5min,(或使用0.22µm滤膜过滤),取上清,-80°C保存,干冰运输 |
| 唾液 | ≥100 μL | 禁食两小时以上,9-12am取样,1000g-2000g离心5min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 泪液 | ≥300 μL | 收集样品(可利用capillary micropipette或Schirmer strip),8000-14000g 4度 离心5min,取上清, -80°C保存,干冰运输 |
| 尿液 | ≥10 mL | 5000×g 4°C 离心30-60min,取上清, -80°C保存,干冰运输 |
| 分泌蛋白-细胞分泌液 | ≥5 mL | 10000g-20000g离心30-60min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 分泌蛋白-脑组织分泌液 | ≥5 mL | 10000g-20000g离心30-60min,(或使用0.22um滤膜过滤),取上清,-80°C保存,干冰运输 |
| 分泌蛋白-间质液 | ≥100 μL | 样品收集,-80°C保存,干冰运输 |
| IP样品 | ≥50 μg | 样品洗脱时,建议采取酸性洗脱模式,wash buffer中不建议含有去垢剂(SDS,NP-40,Triton-X100),若需要使用去垢剂作为洗脱溶液,则需要采用SDS-PAGE对样本进行预处理,送样前,迅速液氮中速冻,并保存于-80°C中,干冰运输 |
解答:TMT 技术使用一种特殊的试剂,其中包含多个同位素标记的基团。这些标记试剂与肽段的 N 端或赖氨酸侧链连接,形成具有不同质量数的标记肽段。标记后的肽段混合在一起,通过质谱分析,每个标记肽段都会产生一个独特的报告离子。通过比较这些报告离子的强度,可以定量不同样品中肽段的相对丰度,进而推导出蛋白质的定量信息。
解答:TMT 技术与 iTRAQ 技术的主要区别在于标记试剂的种类和数量。TMT 技术使用的标记试剂可以提供更多的标记组合,从而允许在一次实验中同时分析更多的样品(最多可达 16 个)。此外,TMT 技术的报告离子强度通常更高,可能提供更好的定量准确性。
解答:TMT 技术的优点包括高通量、高灵敏度、高准确性和灵活性。该技术可以同时分析多个样品,减少了实验时间和成本。TMT 标记试剂的设计使得标记过程相对简单和快速。此外,由于报告离子的强度较高,TMT 技术通常具有较好的定量准确性。
解答:在使用 TMT 技术进行蛋白质组学研究时,需要注意样品的质量、标记效率、质谱分析的参数设置等问题。样品应尽可能纯净,以减少杂质对定量结果的干扰。标记效率会影响定量准确性,因此需要优化标记条件。此外,质谱分析过程中的参数设置也会影响定量结果的准确性和可靠性。
解答:TMT 技术广泛应用于生物学、医学和药学等领域的研究。例如,该技术可以用于研究疾病发生发展过程中的蛋白质表达变化、药物作用机制的探索以及生物标志物的发现等。TMT 技术的高通量特性使其特别适用于大型研究项目,如人类蛋白质组计划等。
TMT (Tandem Mass Tag) 技术是一种用于蛋白质组学研究的同位素标记定量方法。与 iTRAQ 技术类似,TMT 也使用特定的同位素标签来标记来自不同样品的肽段,并通过质谱分析来比较这些标记肽段的强度,从而进行蛋白质定量分析。以下是关于 TMT 蛋白组技术检测蛋白的一些常见疑问及其解答:
1、TMT 技术的工作原理是什么?
2、TMT 技术与 iTRAQ 技术有何不同?
3、TMT 技术有哪些优点?
4、TMT 技术需要注意哪些问题?
5、TMT 技术在哪些领域有应用?