

MST原理
通过对分子间相互作用分析,不仅可阐明细胞生物学事件,而且为疾病发生机制和药物发现提供基础。微量热泳动(microscale thermophoresis,MST)是一种分析生物分子相互作用的技术。
MST技术是一种基于检测在温度梯度中的生物分子电泳迁移率的变化而检测生物分子间结合、解离过程,获取分子间相互作用的模式和动力学常数等方面信息的新技术,是近年来发展的研究生物分子相互作用的强有力工具,已广泛应用于药物筛选、信号转导、分子检测和医学诊断等生命科学领域。
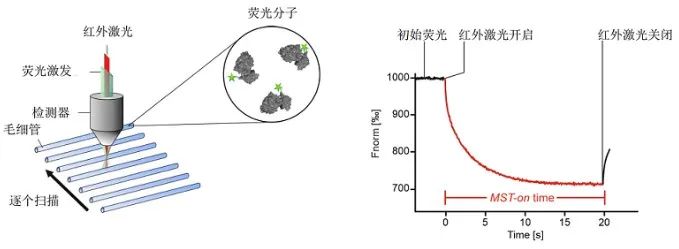
MST是一种表征生物分子特性的光学方法,是粒子在微观温度梯度中的定向运动。将其中一个互作分子(大多是蛋白)标记荧光染料或者融合GFP标签,将标记蛋白和配体分子按照特定的浓度梯度置于毛细管中,红外激光加热产生一个微观的温度梯度场发生热泳动,其水化层、分子大小、电荷等分子性质会随着热泳动发生改变,进而引起反应体系中荧光分布的变化。
MST仪器通过记录激光器打开前、打开期间和打开后处于温度梯度中的样品内部红外激光照射区域的荧光变化情况,从而实现较短时间的测定。MST除了能精确检测生物分子间相互作用,通过计算解离常数(Kds),还能得到有关生物分子互作的其他参数,实现精确的定性分析。
优点:
①检测下限低,弱分子力首选;
②需固定样品,且样品用量较小,ug级别就能开展检测;
③无需使用抗体,无需获得高纯度蛋白,直接使用Tris-NTA dye标记His-Tag融合蛋白,即可上机进行检测;
④能够测量复杂生物溶液(细胞裂解物、血清、洗涤剂、脂质体等);
⑤相互作用物尺寸范围广;
⑥不仅能定性两个生物分子的互作关系,还可以定量判断结合的亲和力强弱。
缺点:
①需要内部荧光或荧光标记(受标记效率、特异性和荧光猝灭的影响);
②无动力学信息(即缔合率和解离率)和浓度分析;
③若互作蛋白与其他分子形成复合体或者于其他分子存在竞争,会影响结合数据;
④若蛋白存在翻译后的修饰,不同体系检测的数据会发生漂移;
⑤若待测蛋白在实验体系中稳定性不佳,会影响数据的稳定性。
MST应用范围
1、蛋白-小分子相互作用分析(蛋白酶与抑制剂、细胞膜蛋白活性)
2、蛋白-蛋白相互作用分析(包括抗原-抗体、分子伴侣-底物)
3、蛋白-肽相互作用分析
4、肽-肽相互作用分析
5、蛋白-核酸相互作用分析
6、核酸-核酸相互作用分析
7、核酸适配子-小分子相互作用分析
小分子药物与蛋白相互作用分析
题目:Paris saponin VII, a Hippo pathwayactivator, induces autophagy and exhibits therapeutic potential against humanbreast cancer cells;
期刊:Acta pharmacologica Sinica,医学一区,IF=7.169;
研究内容:通过MST技术检测发现小分子化合物PSVII与Hippo通路关键蛋白LATS1、MOB1、MST2存在相互作用。研究揭示了PSVII抑制乳腺癌的分子机制,为乳腺癌的治疗提供了新的治疗靶点及靶向治疗药物用于后续研究。

MST技术验证PSVII与LATS1、MOB1、MST2的相互作用
蛋白与核酸相互作用分析
题目:High Osmotic Stress Increases OmpK36Expression through the Regulation of KbvR to Decrease the AntimicrobialResistance of Klebsiella pneumoniae;
期刊:Microbiology Spectrum,微生物学二区,IF=9.043;
研究内容:使用MST技术,通过标记纯化的KbvR蛋白,定量检测其与ompK36和modA启动子区之间结合作用,发现了KbvR能够直接调控OmpK36的表达。
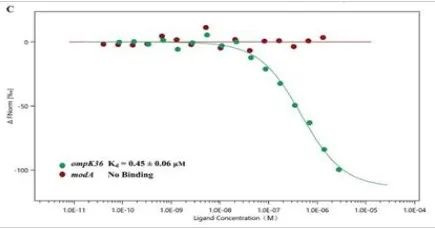
MST技术验证KbvR与OmpK36的亲和力
提供最少样品量:蛋白1mg,小分子100mM/1mL,蛋白多肽需低温寄送。
送样详情可联系技术经理详细沟通。
微量热泳动(MST)测试是一种用于研究分子间相互作用的技术,具有灵敏度高、样品用量少等优点。在进行MST测试时,需要注意以下事项:
样品准备:确保样品纯度高、无杂质,并避免使用对测试有干扰的溶剂或添加剂。同时,样品的浓度和体积应符合仪器要求。
荧光标记:MST测试需要利用荧光信号来检测分子间的相互作用,因此需要对样品进行荧光标记。在选择荧光染料时,应考虑其对样品的亲和性、光稳定性以及荧光信号的强度。同时,标记过程应避免对样品产生不良影响。
仪器校准:在进行MST测试前,应对仪器进行校准,确保测试结果的准确性。校准包括光学系统的校准、温度控制系统的校准等。
实验条件:MST测试的实验条件包括温度、pH值、离子强度等,这些条件会对测试结果产生影响。因此,在实验前应仔细选择和优化实验条件,以获得可靠的结果。
数据处理:MST测试产生的数据需要进行处理和分析,以提取有用的信息。在处理数据时,应注意去除背景信号、拟合曲线等步骤,以获得准确的结合常数(Kd)等信息。
重复实验:为了确保测试结果的可靠性,建议进行多次重复实验,并对结果进行统计分析。