

DSF原理
差示扫描荧光法(Differential Scanning Fluorimetry, 简称DSF),是在荧光定量PCR仪上缓慢加热样品,在加热的过程中检测荧光染料与结构发生改变的蛋白质相结合的量,来评价蛋白质热稳定性的方法。该方法具有蛋白样品损耗少、通量高、温度变化范围广及数据准确等优点,被广泛用于蛋白质稳定性(蛋白质热稳定性参数及其影响因素)、蛋白结构和构象、蛋白-配体相互作用及蛋白质稳定剂、抑制剂、辅助因子等领域的研究。DSF可以通过荧光染料或蛋白内源荧光信号监测升温过程中蛋白构象的变化计算其熔解温度Tm(折叠蛋白与去折叠蛋白相等时的温度)。染料法DSF最常用的是SYPRO Orange染料,SYPRO Orange 是一种环境敏感的疏水染料,当温度升高时,蛋白去折叠,疏水部分暴露出来,染料与蛋白质的疏水部分特异性结合,荧光增强。在有特定化合物或配体结合的情况下,蛋白稳定性会上升,表现为熔解温度的上升。
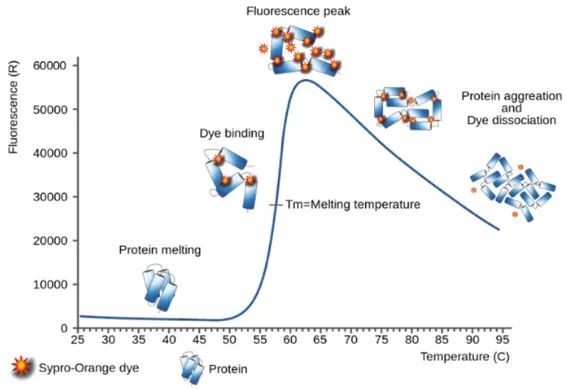
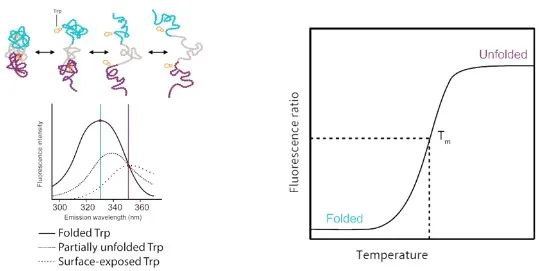
无标记DSF (Nano DSF)则是基于蛋白去折叠过程中色氨酸发射光谱的位移进行检测。因此,通过检测荧光变化,可实现在非标记环境下评估蛋白质热稳定性、化学稳定性、胶体稳定性、等温稳定性、变复性能力等性质。
DSF优点
1、Nano DSF无需染料:直接检测蛋白紫外荧光;
2、初步或者大量检测蛋白与化合物之间是否有结合力;
3、低样品消耗量:每个样品仅需10 μL,最低浓度仅需0.5 μg/mL;
4、数据精度高:CV<0.1% (Tm);
5、温度变化范围广。
1、蛋白质稳定性评估
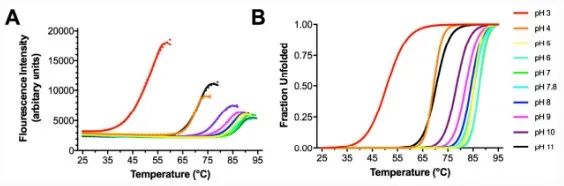
大多数蛋白质对温度要求较高,评估其热稳定性对更好地发挥其功能非常重要。DSF不但可以高通量测定蛋白质的热稳定参数,还能评估突变、pH、离子强度等其他因素对热稳定性的影响,筛选出提高热稳定性的因素。
2、蛋白质结构研究
蛋白质结晶是研究蛋白质结构的一个非常重要的手段,DSF可以高通量筛选蛋白质的结晶条件。
3、蛋白质-配体相互作用研究
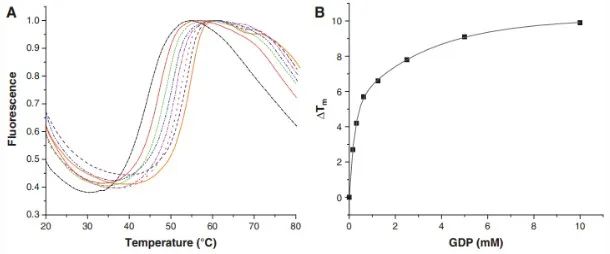
配体与蛋白质结合一般会导致蛋白质的热稳定性改变,DSF可以通过测定蛋白质的热稳定性参数评估配体与蛋白质之间的相互作用。
4、蛋白质稳定剂、抑制剂的高通量筛选
通过对化合物配体库进行高通量筛选,获得与蛋白样品相结合的候选化合物,评估化合物对蛋白稳定性的影响,从而筛选出蛋白质稳定剂、抑制剂、辅助因子及分子伴侣
5、小分子化合物抑制机制研究
利用 DSF 可以进行高通量、矩阵式的多种化合物检测(化合物与一些已知的抑制剂、底物、产物或辅助因子等结合),用于小分子化合物抑制剂的筛选及其药理机制的研究。
初步或者大量检测蛋白与化合物的是否有作用力。
检测蛋白稳定性。
必须有一种是蛋白。
最少提供量:蛋白浓度10uM/15ul,小分子10mM/15ul,蛋白多肽需低温寄送。
差示扫描荧光法(DSF)是一种常用的分析技术,广泛应用于蛋白质稳定性、结构和相互作用的研究。在进行DSF实验时,需要注意以下几个方面:
样品准备:确保样品的质量和纯度,避免污染和降解。对于蛋白质样品,可能需要进行适当的折叠和纯化,以确保其具有正确的结构和活性。同时,注意样品的浓度和体积,以符合实验要求。
荧光染料选择:DSF实验常用的荧光染料包括SYPRO Orange、SYPRO Red等。根据实验需求和目的选择合适的荧光染料。不同的染料可能对不同的蛋白质具有不同的敏感性和特异性,因此需要根据实际情况进行选择。
温度范围设置:DSF实验需要设置合适的温度范围,以覆盖蛋白质的熔解温度(Tm)。根据实验目的和蛋白质的特性,选择合适的起始温度、终止温度和升温速率。确保温度范围足够宽,以充分观察蛋白质的热稳定性变化。
仪器校准:在进行DSF实验前,需要对荧光定量PCR仪进行校准,确保温度控制和荧光检测的准确性。定期检查和维护仪器,以保证实验结果的可靠性。
数据分析:DSF实验产生的数据需要进行适当的分析以提取有用的信息。通过荧光信号的变化,可以计算蛋白质的熔解温度(Tm)和其他相关参数。使用合适的软件或工具进行数据分析,并根据需要进行数据拟合和统计处理。
实验重现性:为了确保实验结果的可靠性,需要在不同时间、不同批次和不同实验人员之间保持实验的重现性。这要求实验条件、设备参数和样品处理方法等都要保持一致,并且需要定期对设备进行校准和维护。
总之,在进行差示扫描荧光法(DSF)实验时,需要注意样品准备、荧光染料选择、温度范围设置、仪器校准、数据分析和实验重现性等方面。通过遵循这些注意事项,可以获得更准确、可靠和可重现的实验结果。